News - Events
Latest news
A selection of recent relevant news
-
Published on
12th iGE3 Annual Meeting
Louis-Jeantet Foundation, Geneva - November 9, 2023 - Registration deadline: October 31, 2023

-
Published on
11th iGE3 PhD Awards - Call for application
For graduate students working in the laboratories of iGE3 members - Registration is closed

-
Published on
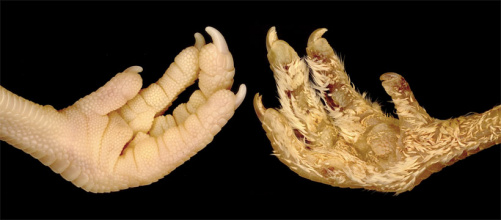
Scales or feathers? It all comes down to a few genes
Publication by Milinkovitch group
-
Published on
Gene responsible for severe facial defects identified
Publication by Antonarakis group
-
Published on
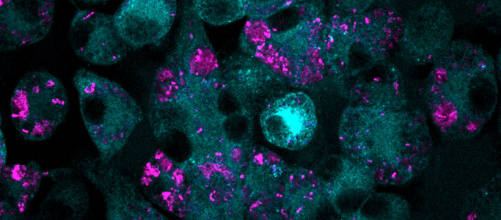
Bypassing antibiotic resistance with a combination of drugs
Publication by Kline group
-
Published on
Prix 3R 2023
Un des Prix 3R 2023 récompense Vladimir Katanaev

-
Published on
Prix Leenaards 2023
Un des trois Prix Leenaards 2023 décerné à Camilla Bellone

-
Published on
iGE3 conference - Silvia Arber
Neuronal circuits for body movements

-
Published on
New iGE3 member - Sophie Martin

-
Published on
New iGE3 member - Christoph Scheiermann

-
Published on
11th iGE3 Annual Meeting
Louis-Jeantet Foundation, Geneva - Hybrid via Zoom

-
Published on
10th iGE3 PhD Awards - Final selection

UNIGE Event Agenda
AtelierAteliers REGARD: Reconnaître et affirmer ses potentiels
More information26.04.2024 09:15 – 17:00 / Université de Genève
AtelierSortie au marché des plantons avec l'EDD!
More information26.04.2024 10:00 – 13:00 / Aux serres du parc Beaulieu 3 rue Elisabeth-Baulacre 1202 Genève (Rive Droite)
SéminaireVolumes of moduli spaces of super hyperbolic surfaces (Paul Norbury, Melbourne)
More information26.04.2024 10:30 / Conseil Général 7-9 / Room 1-05, Séminaire "Physical Mathematics Seminar"
SéminaireSéminaire international: un état des lieux du covid long (post-covid)
More information26.04.2024 11:30 – 15:00 / HUG / Auditoire de Pédiatrie Fred Bamatter Hôpital des enfants (HUG), 2ème étage
SéminaireLate-time domain walls in cosmological simulations
More information26.04.2024 11:50 – 12:50 / Ecole de Physique / EP234
SéminaireLeçons de privat-docents
More information26.04.2024 12:00 – 13:40 / CMU / Auditoire Renold
SéminaireREGULATION OF SMOOTH MUSCLE CELLS IN VASCULAR DISEASE
More information26.04.2024 12:15 – 13:00 / CMU / Jacques‐Louis Reverdin (B02.2526.a)
AtelierValoriser sa recherche avec son identifiant ORCID, l'essentiel en 15 minutes
More information26.04.2024 14:00 – 14:15 / En ligne, sur Zoom
Soutenance de thèseLaser-guided Lightning: Atmospheric Discharges Controlled by High-repetition Rate Laser Filaments
More information26.04.2024 14:00 – 16:00 / Ecole de Physique / Auditoire Stueckelberg Rue Quai-Ansermet 24, 1205 Genève
Soutenance de thèseRevealing the Nanoscale Architecture of the Cell with Iterative Ultrastructure Expansion Microscopy (iU-ExM)
More information26.04.2024 14:15 – 16:15 / Sciences II / Audtoire A100, Quai Ernest-Ansermet 30, 1205 Genève
AtelierValoriser sa recherche avec son identifiant ORCID, prise en main et paramétrages avancés du profil
More information26.04.2024 14:30 – 15:45 / En ligne, sur Zoom
ConférenceDe la molécule au médicament, un voyage au travers des différentes étapes de développement
More information26.04.2024 14:30 – 16:00 / Maison internationale des Associations (MIA) | Salle Gandhi
Soutenance de thèseLes mesures provisoires devant la Commission et la Cour africaines des droits de l’homme et des peuples
More information26.04.2024 14:30 – 17:30 / Uni Mail / Salle M3050 - 3ème étage
ExpositionVernissage de l'exposition « Ex-EROTICIS: Art et fierté du livre secret »
More information26.04.2024 18:30 – 21:30 / Battelle / Bâtiment A, 7 route de Drize, 1227 Carouge
ThéâtrePorcile de Pier Paolo Pasolini
More information26.04.2024 20:00 – 21:30 / Uni Mail / Uni Mail | Salle de spectacle (MS 180) Bd du Pont-d'Arve 40
ExpositionPerspectives – L’univers mathématique de M.C. Escher
More information26.04.2024 07:30 – 19:00 / Bâtiment 66 bd Carl-Vogt / Salle d'exposition de l'UNIGE
Cours publicEcrire dans une langue “rescapée": pages d'exil dans la littérature arménienne contemporaine
More information26.04.2024 14:15 – 16:00 / Philosophes / 22 Bd des Philosophes 1205 Genève Salle Phil 204
ExpositionÀ travers rues
More information15.04.2024 08:00 – 10.05.2024 17:00 / Uni Dufour, hall Rue du Général-Dufour 24, 1204 Genève










